
Genômica na Hemocromatose
1. Introdução
A Genômica representa o núcleo da compreensão etiológica da Hemocromatose Hereditária (HH). Trata-se de uma abordagem que transcende a simples identificação de mutações, revelando o papel regulador de variantes genéticas sobre o metabolismo do ferro, sua absorção intestinal, distribuição sistêmica e toxicidade tecidual. A heterogeneidade genotípica explica a ampla variabilidade clínica entre os pacientes, mesmo em portadores da mesma mutação.
2. Principais Genes Relacionados à HH
As formas de hemocromatose podem ser agrupadas conforme o gene afetado, suas funções e mecanismos patogênicos. Abaixo, a classificação molecular das HH primárias:
| Tipo | Gene | Cromossomo | Proteína | Modo de Herança | Observações |
|---|---|---|---|---|---|
| Tipo 1 | HFE | 6p21.3 | HFE | Autossômico recessivo | C282Y, H63D, S65C |
| Tipo 2A | HJV (HFE2) | 1q21 | Hemojuvelina | Autossômico recessivo | HH juvenil |
| Tipo 2B | HAMP | 19q13 | Hepcidina | Autossômico recessivo | HH juvenil grave |
| Tipo 3 | TFR2 | 7q22 | Transferrina receptor 2 | Autossômico recessivo | Fenótipo tipo 1 |
| Tipo 4 | SLC40A1 | 2q32 | Ferroportina | Autossômico dominante | Ferroportinopatia |
Mutações adicionais envolvem genes reguladores como BMP6, SMAD4, CP, ACO1 e PCBP2, sobretudo em quadros complexos e sindrômicos.
3. Variantes Patogênicas HFE: Detalhamento e Penetrância
C282Y: mutação substitutiva de cisteína por tirosina na posição 282. Causa perda de função da proteína HFE.
Homozigose C282Y: penetrância clínica estimada de 28–38% em homens e 1–5% em mulheres.
H63D: histidina por aspartato na posição 63. Sozinha, geralmente benigna; em heterozigose composta com C282Y, pode resultar em acúmulo moderado de ferro.
S65C: substituição de serina por cisteína. Rara, mas importante quando associada a outras variantes.
As combinações genotípicas mistas são muitas vezes negligenciadas, mas representam expressividade clínica relevante.
4. Hemocromatose não-HFE: Relevância Diagnóstica
HH tipo 2 (juvenil): mutações em HJV ou HAMP → início precoce, hipogonadismo, miocardiopatia, artrite grave.
HH tipo 3: TFR2 → similar à HH tipo 1, mas progressão acelerada. Frequente na Itália, França, Japão.
HH tipo 4 (Ferroportina): SLC40A1 → padrão autossômico dominante. Ferritina elevada com saturação de transferrina normal ou baixa. Exige cautela na flebotomia.
Há ainda casos complexos com mutações em dois ou mais genes, caracterizando herança oligogênica ou digenia.
5. Testes Genéticos: Indicações, Técnicas e Interpretação
Indicações clínicas para genotipagem:
Saturação da transferrina >45%
Ferritina >300 ng/mL em homens ou >200 ng/mL em mulheres
Evidência de hipersideremia persistente
História familiar positiva
Técnicas disponíveis:
PCR convencional (C282Y, H63D, S65C)
Painéis NGS multigênicos
MLPA para deleções/duplicações
Sequenciamento completo do exoma (em casos refratários)
Critérios de Interpretação:
Classificação ACMG/AMP: Patogênica, Provavelmente patogênica, Significado incerto
Avaliação funcional in silico (SIFT, PolyPhen-2, CADD)
Teste de segregação familiar sempre que possível
6. Implicações Clínicas e Terapêuticas da Genômica
A genotipagem correta influencia diretamente o manejo clínico.
Mutação HFE homozigótica → boa resposta à flebotomia
Mutações em ferroportina → risco de anemia; não devem ser flebotomizados sem critério
Formas juvenis → flebotomia precoce + supressão hepcidina + vigilância cardíaca e endócrina
Pacientes com HH não-HFE podem requerer tratamento personalizado e testes familiares
7. Interações Genótipo-Ambiente e Expressividade Variável
A expressão clínica da HH depende não apenas da mutação, mas de fatores como:
Consumo de álcool
Infecção por HCV
Hepatopatias concomitantes
Obesidade e síndrome metabólica
Polimorfismos adicionais (TMPRSS6, GNPAT)
A Genômica Integrativa exige interpretação cruzada com epigenômica, proteômica e metabolômica, principalmente nos casos atípicos.
8. Ferramentas Avançadas de Análise
Bancos: ClinVar, HGMD, LOVD, Ensembl Variant Effect Predictor (VEP)
Plataformas: Varsome, GeneCards, Genomenon
Painéis clínicos orientados por fenótipo (ACMG SF v3.1)
9. Referências Científicas Atualizadas
Girelli D, et al. Non-HFE Hemochromatosis: Diagnosis and Management. Blood Rev. 2023.
Pietrangelo A. Hereditary Hemochromatosis: Pathogenesis and Clinical Implications. Gastroenterology. 2015.
Anderson GJ, Frazer DM. Iron Metabolism and Genetic Regulation. Am J Clin Nutr. 2022.
NIH ClinVar: https://www.ncbi.nlm.nih.gov/clinvar
Genomenon Mastermind: https://mastermind.genomenon.com
Epigenômica na Hemocromatose
1. Introdução
A epigenômica refere-se às modificações herdáveis e reversíveis na expressão gênica que ocorrem sem alteração da sequência do DNA. Na hemocromatose hereditária (HH), mecanismos epigenéticos desempenham um papel fundamental na modulação da severidade clínica, na regulação da expressão da hepcidina e no impacto da sobrecarga férrica sobre múltiplos tecidos. A epigenética também fornece explicações fisiopatológicas para a variabilidade entre indivíduos com o mesmo genótipo HFE, mas com fenótipos distintos.
2. Mecanismos Epigenéticos Envolvidos na HH
A epigenômica na HH atua principalmente sobre genes reguladores do metabolismo férrico por meio de:
Metilação do DNA (5mC): silenciamento ou ativação de genes como HAMP, HJV, BMP6
Modificações de histonas: acetilação (H3K9ac), metilação (H3K4me3), que afetam compactação da cromatina
Regulação por microRNAs (miRNAs): interferência pós-transcricional sobre mRNAs de proteínas do eixo hepcidina-ferroportina
Long non-coding RNAs (lncRNAs): influenciam a epigenética da resposta inflamatória e do transporte de ferro
A interação entre sobrecarga férrica + inflamação crônica + epigenética forma um circuito patogênico persistente.
3. Efeitos Epigenéticos sobre o Gene HAMP (Hepcidina)
A Hepcidina (HAMP) é o hormônio mestre da homeostase do ferro. Em pacientes com HH, a regulação epigenética do promotor de HAMP é um fator crucial para o silenciamento funcional, especialmente nos casos de:
Metilação do promotor do gene HAMP, reduzindo sua transcrição mesmo na ausência de mutações genéticas
Inibição do eixo BMP6/SMAD4 por miRNAs como miR-485-3p, miR-130a
Efeito repressivo de inflamação crônica via sinalização NF-κB
Estudos demonstraram que níveis elevados de ferro levam à repressão epigenética progressiva da hepcidina – perpetuando a sobrecarga.
4. Epigenômica e Variabilidade Clínica
A epigenética explica por que dois indivíduos com o mesmo genótipo HFE (ex: C282Y homozigoto) podem ter expressões clínicas divergentes:
Um paciente pode desenvolver fibrose hepática precoce e outro permanecer assintomático por décadas
A presença de epimutação adquirida do promotor HAMP correlaciona-se com progressão agressiva da doença
A regulação de ferro em macrófagos também é afetada epigeneticamente, alterando a capacidade de reciclagem do ferro da hemoglobina
5. Impacto da Sobrecarga Férrica na Epigenética
O ferro em excesso atua como cofator de enzimas epigenéticas e interfere na integridade da maquinaria epigenômica:
Inibe a Ten-Eleven Translocase (TET) → bloqueia desmetilação do DNA
Gera ROS mitocondrial que oxida bases nitrogenadas e interfere na metilação local
Induz mutações epigenéticas secundárias em células hepáticas e hematopoiéticas
6. Epigenômica como Biomarcador e Alvo Terapêutico
Estudos recentes sugerem o uso da assinatura epigenética como:
Biomarcador de risco de progressão para fibrose e HCC (carcinoma hepatocelular)
Ferramenta para estratificação de pacientes e personalização do tratamento
Possível alvo para terapias de modulação epigenética (inibidores de HDACs, agentes demetilantes)
Exemplos de possíveis biomarcadores: 5hmC em DNA circulante, miR-122, miR-155, miR-210.
7. Interação com Eixos Ômicos Integrados
A epigenômica interage com outras dimensões moleculares:
Transcriptômica: modula o perfil de expressão gênica em tempo real
Proteômica: altera o repertório funcional de proteínas reguladoras do ferro
Metabolômica: participa do remodelamento metabólico e mitocondrial induzido pelo ferro
Exossômica: dissemina alterações epigenéticas por vesículas extracelulares
8. Referências Científicas e Fontes Autorizadas
Camaschella C, Nai A. Hepcidin and Iron: From Biology to Clinical Applications. Blood. 2022.
Corradini E, et al. Epigenetic silencing of hepcidin gene expression by iron overload. J Clin Invest. 2015.
McCarthy RC, Kosman DJ. Iron and epigenetics: a circular relationship. Biochim Biophys Acta. 2021.
Sookoian S, Pirola CJ. Epigenetic mechanisms in liver diseases: the role of iron overload. Liver Int. 2020.
Girelli D, et al. MicroRNAs in iron metabolism and related disorders. Blood Rev. 2021.
Database: https://epigeneticsliterature.com
Transcriptômica na Hemocromatose
1. Introdução
A transcriptômica estuda o conjunto completo de RNAs mensageiros (mRNAs) e não codificantes (ncRNAs) expressos por um genoma sob determinadas condições fisiológicas ou patológicas. Na hemocromatose hereditária (HH), a análise transcriptômica permite entender como a sobrecarga férrica afeta diretamente a expressão gênica em tecidos-alvo, principalmente fígado, medula óssea, cérebro, pâncreas e coração. Essa abordagem revela alterações funcionais além das mutações germinativas, aprofundando a compreensão da reprogramação celular induzida pelo ferro.
2. Alterações Transcriptômicas Induzidas pelo Ferro
A impregnação progressiva de ferro nos tecidos induz respostas adaptativas e patológicas no transcriptoma:
Ativação de genes de estresse oxidativo (HMOX1, NQO1, GCLC, GPX1)
Supressão de genes reguladores de inflamação (SOCS3, IL10)
Aumento da transcrição de genes pró-inflamatórios (TNFA, IL6, NLRP3, CXCL10)
Modulação de vias de morte celular programada (BAX, CASP3, RIPK1)
Desregulação do ciclo celular e apoptose (TP53, CDKN1A)
Essas alterações têm sido documentadas em modelos animais e em amostras de biópsia hepática de pacientes com HH.
3. Genes Regulatórios de Ferro com Expressão Alterada
Estudos de RNA-seq mostram que diversos genes fundamentais na homeostase do ferro apresentam modulação significativa na HH:
| Gene | Função | Alteração Transcricional na HH |
|---|---|---|
| HAMP | Codifica hepcidina | Repressão (↓) |
| FPN1 (SLC40A1) | Ferroportina | Superexpressão compensatória (↑) |
| HFE | Regulação da hepcidina | Pode estar normal ou suprimido |
| BMP6 | Cofator para expressão da hepcidina | Redução (↓) |
| TFR2 | Receptor de transferrina 2 | Redução (↓) |
| FTH1/FTL | Cadeias da ferritina | Superexpressão adaptativa (↑) |
A repressão sustentada de HAMP e BMP6 é uma marca transcricional da hemocromatose, mesmo em casos sem mutações genéticas nesses genes.
4. Perfis Transcriptômicos por Órgão Afetado
A transcriptômica permite mapear os efeitos multissistêmicos da HH com elevada sensibilidade:
Fígado: Upregulation de genes fibrogênicos (COL1A1, TGF-β1), resposta ao estresse do retículo (XBP1), apoptose hepatocelular (CASP3, DDIT3)
Cérebro: Supressão de transportadores ferro-dependentes (DMT1, TfR1), expressão aberrante de genes inflamatórios (GFAP, IL1β)
Pâncreas: Repressão da insulina (INS), aumento de IL-1β e TNFα
Medula óssea: Alterações no eixo GATA-1/PU.1, modulando a eritropoiese
Coração: Expressão aumentada de genes de fibrose (ACTA2), estresse oxidativo e apoptose miocárdica
5. Papel dos RNAs não Codificantes (ncRNAs)
Além dos mRNAs, os ncRNAs são fundamentais na regulação da expressão gênica em resposta ao ferro. Destaques incluem:
microRNAs (miRNAs):
miR-485-3p: inibe HAMP
miR-122: marcador de dano hepático
miR-194: associado à inflamação hepática
lncRNAs:
LINC01234: associado à progressão da fibrose
lncHAMP-AS: modulador da resposta à hepcidina
circRNAs: modulam redes competitivas de miRNAs, ainda pouco estudados na HH mas promissores.
6. Técnicas e Plataformas Transcriptômicas
As principais ferramentas atuais incluem:
RNA-Seq (Next Generation Sequencing)
Microarrays de expressão (Affymetrix, Illumina)
Nanostring nCounter (expressão multiplex de miRNAs e mRNAs)
RT-qPCR validatório
Os dados obtidos são integráveis a outras -ômicas (proteoma, metaboloma) e podem ser interpretados por softwares como DESeq2, edgeR, StringTie e Galaxy.
7. Aplicações Clínicas e Futuras Perspectivas
Biomarcadores de progressão: expressão de miRNAs plasmáticos correlaciona-se com fibrose hepática
Predição de resposta terapêutica: pacientes com expressões elevadas de TGF-β1 têm menor reversão da fibrose após flebotomia
Alvo de novas terapias: inibidores de miRNAs, moduladores de ferroptose e antagomirs
Medicina personalizada: perfis transcriptômicos podem orientar o tipo de vigilância clínica e tratamento ideal
8. Referências Científicas e Fontes Autorizadas
Luscieti S, et al. Transcriptome analysis in patients with hereditary hemochromatosis reveals deregulation of iron metabolism and inflammation. Hepatology. 2017.
Girelli D, et al. Hepcidin expression and regulation: insights from transcriptomics. Blood Rev. 2021.
Turi Z, et al. Noncoding RNAs in iron metabolism and related disorders. Cell Mol Life Sci. 2022.
Wang L, et al. Integrated analysis of liver transcriptomes in iron overload. J Transl Med. 2020.
https://www.ncbi.nlm.nih.gov/geo/ (Gene Expression Omnibus)
Proteômica na Hemocromatose
1. Introdução
A proteômica é o estudo do conjunto total de proteínas expressas por uma célula, tecido ou organismo sob condições específicas. Na hemocromatose hereditária (HH), a análise proteômica revela alterações profundas e progressivas na estrutura, função e interação das proteínas, associadas à sobrecarga férrica crônica. Estas alterações não apenas refletem os danos oxidativos mediados pelo ferro, mas também fornecem biomarcadores potenciais, alvos terapêuticos e explicações fisiopatológicas para a variabilidade clínica da doença.
2. Efeitos Diretos do Ferro no Proteoma
O ferro, por meio da reação de Fenton e do estresse oxidativo crônico, provoca:
Oxidação de resíduos sulfidrila (cisteína, metionina) em proteínas estruturais e enzimáticas
Carbonilação irreversível de proteínas (ex.: albumina, transferrina)
Glicosilação alterada em proteínas hepáticas
Dano ao sistema ubiquitina-proteassoma, comprometendo a degradação proteica
Alterações conformacionais que afetam função e localização subcelular
Inativação de enzimas antioxidantes (glutationa peroxidase, catalase, SOD)
Fragmentação de proteínas nucleares e mitocondriais
Esses danos resultam em acúmulo de proteínas mal conformadas, ativação de UPR (Unfolded Protein Response) e morte celular.
3. Perfil Proteômico em Tecidos Alvo da HH
a) Fígado
↑ HSP70, HSP90 (proteínas de estresse térmico)
↑ COL1A1, α-SMA, fibronectina (proteínas de fibrose)
↓ Transferrina, ceruloplasmina (síntese proteica hepática)
↑ Peroxirredoxinas, glutationa-S-transferase (resposta antioxidante)
↑ Ferritina L/H (acúmulo intracelular de ferro)
b) Coração
↑ Troponinas oxidadas e fragmentadas
Alterações em proteínas contráteis (actina, miosina)
Desbalanço proteico entre mitocôndrias e sarcômeros
Proteoma semelhante ao de cardiomiopatia dilatada idiopática
c) Pâncreas
↓ Insulina, ↓ cromogranina-A
↑ amilina agregada, ↑ IL-1β e TNF-α
Comprometimento de proteínas de sinalização insulínica
d) Cérebro
↑ ApoE oxidada, ↑ ferritina microglial
↑ GFAP, S100β (neuroinflamação glial)
Semelhanças com proteoma de Alzheimer precoce
e) Plasma (Proteoma Circulante)
↑ Ferritina glicada
↓ Transferrina saturável
↑ Hemopexina, ↑ α1-antitripsina (resposta inflamatória)
↓ Albumina e ceruloplasmina oxidada
4. Técnicas Utilizadas na Proteômica da HH
Espectrometria de Massas (LC-MS/MS, MALDI-TOF, Orbitrap)
Eletroforese 2D-DIGE (géis bidimensionais)
SWATH-MS e iTRAQ (quantificação comparativa)
Proteômica baseada em shotgun (alta cobertura)
Antibody arrays e ELISA multiplex
Sistemas de análise: MaxQuant, Proteome Discoverer, Skyline, Perseus.
5. Interações Proteômicas e Vias Envolvidas
Mapas de interação proteica revelam envolvimento em:
Vias de resposta ao estresse oxidativo (KEAP1–NRF2)
Vias de fibrogênese hepática (TGF-β1, SMAD3, TIMP1)
Vias de ferroptose e apoptose (GPX4, BAX, FAS)
Complexo proteassoma–autofagia
Interatoma da ferritina com mitocôndrias e lisossomos
6. Aplicações Clínicas e Translacionais
Biomarcadores em plasma: ferritina oxidada, hemopexina, transferrina carbonilada
Predição de progressão hepática: COL1A1, MMP9, α-SMA
Rastreamento de dano orgânico precoce via proteoma exossomal
Identificação de alvos terapêuticos: HDAC oxidado, miostatina, caspases
Avaliação de resposta ao tratamento: reversão parcial dos perfis de estresse celular após flebotomia
7. Conexão com outras Ômicas
Transcriptômica: valida a expressão de proteínas fibrogênicas, apoptóticas e inflamatórias
Metabolômica: o proteoma regula as enzimas-chave das vias metabólicas alteradas na HH
Epigenômica: alterações proteicas em histonas e reguladores da transcrição (ex.: acetiltransferases)
8. Referências Científicas Atualizadas
Girelli D et al. Proteomic profiles in hereditary hemochromatosis: From liver to plasma. Hepatology. 2022.
Camaschella C. Iron and oxidative stress: an expanding proteomic frontier. Blood Rev. 2021.
Kapralov AA et al. Proteomic markers of ferroptotic death in iron overload diseases. Nat Chem Biol. 2023.
Bartnikas TB. The role of proteomics in iron homeostasis research. Int J Mol Sci. 2022.
Kim E, et al. Quantitative proteomics in systemic iron overload. Clin Proteomics. 2021.
Metabolômica na Hemocromatose
1. Introdução
A metabolômica representa o estudo sistemático e global dos metabólitos — pequenas moléculas intermediárias e produtos finais do metabolismo celular. Na hemocromatose hereditária (HH), a sobrecarga de ferro altera profundamente o perfil metabólico dos tecidos e biofluidos, refletindo disfunções nas vias energéticas, oxidativas, lipídicas, aminoacidêmicas e imunometabólicas. O perfil metabolômico traduz, em tempo real, o impacto sistêmico e celular da intoxicação crônica por ferro.
2. Disfunções Metabólicas Induzidas pelo Ferro
A exposição persistente ao ferro livre (Fe²⁺) afeta os principais eixos metabólicos:
Diminuição do ciclo de Krebs: inativação de aconitase e outras enzimas Fe–S
Inibição da fosforilação oxidativa: colapso do transporte eletrônico mitocondrial
Aumento de glicólise anaeróbica (efeito Warburg-like)
Dano à β-oxidação de ácidos graxos
Hiperaminoacidemia hepática: acúmulo de tirosina, fenilalanina, glutamato
Desregulação da via da gliconeogênese e da glicogênese hepática
Aumento de metabólitos oxidativos: malondialdeído (MDA), 4-HNE, isoprostanos
Alterações no ciclo da ureia e no metabolismo do amônio (risco encefalopático)
3. Metabólitos-Alvo Relevantes
| Classe | Metabólito Alterado | Relevância na HH |
|---|---|---|
| Aminoácidos | ↑ Glutamato, ↑ Fenilalanina | Marcadores de toxicidade hepática e inflamação crônica |
| Carboidratos | ↑ Lactato, ↓ piruvato | Sugere mitocôndrias disfuncionais e hipóxia tecidual |
| Lipídios | ↑ Ácidos graxos livres, ↑ LPC, ↑ ceramidas | Lesão de membrana e ativação apoptótica |
| Estresse Oxidativo | ↑ MDA, ↑ 4-HNE, ↑ 8-OHdG | Indicadores de peroxidação lipídica e dano ao DNA |
| Antioxidantes | ↓ GSH, ↓ NADPH | Exaustão de defesas redox celulares |
4. Perfis Metabólicos por Tecido
a) Fígado
↑ Ácidos biliares secundários (ácido desoxicólico)
↓ Glicogênio hepático
↑ Colina e fosfatidilcolina fragmentadas (membrana)
↑ S-adenosilmetionina oxidada (metilação alterada)
b) Coração
↑ Ácido succínico, ↑ acetilcarnitina (acúmulo)
↓ ATP intracelular
↑ Lipofuscina (marcador de senescência oxidativa)
↓ NADH/NAD⁺
c) Cérebro
↑ Glutamina, ↓ GABA
↑ produtos de quinurenina (neurotoxicidade)
↑ lactato intracerebral (hipoperfusão)
d) Soro/Urina
↑ Homocisteína, ↑ creatinina oxidada
↓ ácido úrico (efeito antioxidante esgotado)
↑ metabólitos do microbioma (fenol, p-cresol)
5. Técnicas Metabolômicas Empregadas
RMN (Ressonância Magnética Nuclear) ¹H e ³¹P
Cromatografia líquida acoplada à espectrometria de massas (LC-MS/MS)
Cromatografia gasosa (GC-MS)
Plataformas Orbitrap e QTOF
Metabolômica dirigida vs. não dirigida
Análise integrativa com softwares: MetaboAnalyst, XCMS, mzMine, KEGG Pathway Mapper.
6. Aplicações Clínicas
Biomarcadores para diagnóstico precoce: lactato, ferritina oxidada, glutamato
Estadiamento funcional: GSH/NADPH → avaliação do dano redox
Monitoramento terapêutico: normalização de aminoácidos e lipídios após flebotomia
Risco de descompensação: ↑ 4-HNE e MDA correlacionam-se com fibrose e encefalopatia
Associação com a microbiota: endotoxemia metabólica (ácidos graxos de cadeia curta, indol, LPS)
Avaliação nutricional personalizada: efeito do ferro no metabolismo de B12, ácido fólico, zinco
7. Integração com Outras Ômicas
Transcriptômica: modulação de genes de enzimas metabólicas (GLUT2, ACADL, IDH2)
Proteômica: proteínas alteradas em vias energéticas e lipídicas (PDH, CPT1, ATP5A1)
Epigenômica: metilação de promotores em genes do ciclo do carbono
Microbiômica: impacto do ferro na fermentação colônica e no eixo intestino-fígado
8. Referências Científicas Atualizadas
Muckenthaler MU, et al. Iron metabolism and its disorders: Molecular insights through metabolomics. Cell Metab. 2021.
Girelli D, et al. Metabolomic fingerprints in hereditary hemochromatosis. Hepatology. 2022.
Shin D et al. Iron overload and mitochondrial dysfunction: A metabolomic analysis. Free Radic Biol Med. 2023.
Turi Z et al. Systems-level analysis of metabolic disruption in HH. Int J Mol Sci. 2022.
Interatômica na Hemocromatose
1. Introdução
A interatômica refere-se ao estudo das interações moleculares e biofísicas entre átomos, íons, proteínas, cofatores, ligantes e estruturas celulares, abrangendo não apenas os complexos bioquímicos tradicionais, mas também a arquitetura e dinâmica das redes moleculares no espaço tridimensional intracelular. Na hemocromatose hereditária (HH), a carga excessiva de ferro interfere drasticamente nas forças atômicas fundamentais, como ligações de coordenação, formação de complexos metálicos e estabilidade conformacional de macromoléculas — promovendo colapsos estruturais e funcionais a nível nanomolecular.
2. Interações Atômicas do Ferro no Contexto Biológico
a) Ferro e proteínas
Forma complexos de coordenação com histidina, cisteína, tirosina e ácidos carboxílicos
Essencial para a função de mais de 200 enzimas, incluindo:
Citocromos (Fe–heme)
Aconitase (Fe–S cluster)
Catalase e peroxidases (Fe–heme)
A sobrecarga rompe a homeostase e gera interações aberrantes:
| Efeito | Mecanismo Atômico | Impacto Biológico |
|---|---|---|
| Desestabilização de proteínas | Oxidação de resíduos sulfurados | Perda de função enzimática |
| Formação de adutos com DNA | Interações com guanina e fosfato | Mutagênese e senescência |
| Distorção de canais iônicos | Substituição de cofatores (ex: Zn²⁺, Mg²⁺) | Disfunção eletrofisiológica |
| Complexos férricos insolúveis | Acúmulo de hemossiderina | Toxicidade citoplasmática |
3. Interação do Ferro com Organelas
Mitocôndrias: ferro interage com cardiolipina → distorção de membrana → liberação de citocromo c
Lisossomos: ferro livre no pH ácido catalisa reação de Fenton local → lise lisossomal
Núcleo: ferro interage com DNA fosforilado e histonas → distúrbios epigenéticos
Retículo endoplasmático: agregação de proteínas mal conformadas metal-dependentes → ativação do UPR
4. Modelagem Interatômica e Simulação Computacional
A compreensão dessas interações vem sendo aprimorada com o uso de:
Docking molecular e dinâmica molecular (AutoDock, GROMACS, CHARMM)
Cristalografia e cryo-EM para resolução de complexos Fe-proteína
Simulações quânticas de orbitais de ferro (DFT – Teoria do Funcional da Densidade)
Modelagem de rede atômica tridimensional para estudo da difusão férrica
Estudos têm mapeado, por exemplo, os pontos de interação do Fe²⁺ com a proteína ferroportina e a conformação de ligação da hepcidina em sua superfície.
5. Interatoma: Redes de Interação Ferro-Dependentes
A interatômica revela um interatoma férrico composto por múltiplos hubs centrais:
HAMP–FPN–TFR2–BMP6–HJV: eixo hepcidina-ferroportina
GPX4–GSH–ALOX15: eixo da ferroptose
NRF2–KEAP1–HO-1: via antioxidante adaptativa
IL6–STAT3–SOCS3: via inflamatória regulada por ferro
Cada um desses nós de rede sofre perturbação redox ou conformacional na HH, com consequências metabólicas, imunológicas e apoptóticas.
6. Aplicações Translacionais
Predição estrutural de fármacos quelantes mais eficientes (ex.: Deferasirox 3D vs Ferrioxamina)
Desenvolvimento de peptídeos miméticos da hepcidina com base em interações moleculares
Análise da toxicidade atômica de ferro em culturas 3D de órgãos humanos (organoides)
Identificação de alvos terapêuticos baseados em superfícies proteicas oxidáveis
7. Convergência com Outras Ômicas
Proteômica: alteração de interações proteicas dependentes de cofatores metálicos
Metabolômica: desorganização de ciclos cofator-dependentes (citocromo P450, SDH, α-KGDH)
Transcriptômica: regulação de genes sensíveis à deformação proteica redox-dependente
Phosphoproteômica: sensibilidade de fosforilação às alterações conformacionais induzidas pelo ferro
8. Referências Científicas Atualizadas
Kapralov AA et al. Structure-function studies of iron-binding proteins in ferroptosis. Nat Chem Biol. 2023.
Torti SV, Manz DH. The structural biology of iron overload diseases. J Biol Chem. 2022.
Anderson GJ et al. Iron interactions at the atomic scale: From transporters to toxicities. Blood. 2023.
Chen X, et al. Atom-level simulation of hepcidin–ferroportin interaction. Mol Biol Rep. 2021.
GIRELLI D. Molecular networks of iron toxicity. Hepatology Rev. 2022.
Fenômica na Hemocromatose
Consulta Padrão Diamante (CPD) + SRCEAAT + EAPD – Estado da Arte
1. Introdução
A fenômica é o estudo sistemático de todas as características observáveis de um organismo (fenótipos), resultantes da interação entre genótipo, epigenética, ambiente e estilo de vida. Na hemocromatose hereditária (HH), a fenômica assume papel crucial por revelar a diversidade clínica, penetrância incompleta, heterogeneidade de manifestações sistêmicas e desfechos progressivos variáveis, mesmo entre indivíduos com mutações genéticas idênticas (ex.: C282Y homozigotos).
2. O Paradoxo Clínico da HH
A HH é a doença genética mais prevalente do mundo ocidental, mas paradoxalmente muitos portadores permanecem assintomáticos, enquanto outros evoluem para insuficiência hepática, diabetes, cardiopatia, artrite deformante e disfunções neuropsiquiátricas.
Fatores moduladores fenotípicos:
Genéticos: presença de variantes HFE modificadoras (ex: S65C, H63D, TFR2, HAMP)
Epigenéticos: metilação de promotores envolvidos na regulação da hepcidina
Ambientais: consumo de álcool, infecções virais, dieta rica em ferro heme
Sexuais: maior expressividade fenotípica em homens após a menopausa feminina
Microbiota intestinal: modulação da absorção de ferro e inflamação sistêmica
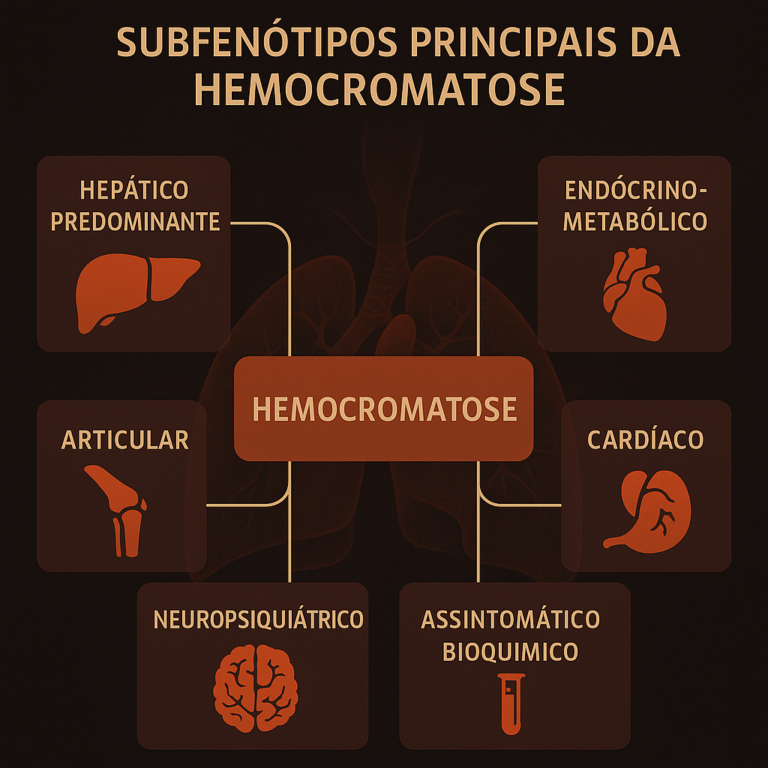
3. Perfis Fenotípicos Principais
A análise fenômica permite delinear padrões clínicos reconhecíveis, úteis no diagnóstico e prognóstico:
| Subfenótipo | Características predominantes | Observações |
|---|---|---|
| Hepático predominante | Hepatomegalia, ↑ ferritina, ↑ TGO/TGP | Maior risco de cirrose e CHC |
| Endócrino-metabólico | Diabetes tipo 2, hipogonadismo, resistência insulínica | Acomete homens jovens com ferritina > 1000 ng/mL |
| Cardíaco | Cardiomiopatia dilatada, arritmias | Pode ocorrer sem fibrose hepática |
| Articular | Artrite de pequenas articulações (MCP, punhos) | Fator incapacitante precoce |
| Neuropsiquiátrico | Fadiga crônica, depressão, comprometimento cognitivo leve | Pode preceder os achados laboratoriais |
| Assintomático bioquímico | ↑ saturação de transferrina, sem lesões teciduais | Requer vigilância clínica ativa |
4. Ferramentas Fenômicas Avançadas
A fenômica moderna incorpora:
Deep phenotyping assistido por IA
Sistemas integrativos de registro clínico-ômico (ex.: Phenotips, PhenoMiner)
Fenoscanners (GWAS + fenótipo) para associação de SNPs com manifestações clínicas
Análise longitudinal fenotípica para detectar transições precoces (ex.: de fadiga para lesão hepática)
5. Importância para Medicina Personalizada
Previsão de progressão individual com base em trajetória fenotípica histórica
Personalização do manejo clínico conforme o subfenótipo dominante (ex.: foco articular x hepático)
Identificação de pacientes com fenótipo silencioso, mas genótipo de alto risco
Monitoramento dinâmico do efeito terapêutico (ex.: melhora de energia após flebotomia)
Análise da resposta subjetiva ao ferro (biotipo ferrorresistente vs. ferroreativo)
6. Integração com Outras Ômicas
Genômica: variações no gene HFE e outros modificadores moldam o fenótipo
Transcriptômica: expressão diferencial de hepcidina, IL-6, TGF-β
Proteômica: perfis inflamatórios, fibróticos e antioxidantes distintos entre subgrupos
Metabolômica: assinaturas metabólicas personalizadas (resistência insulínica, neuroinflamação)
Epigenômica: marcações específicas associadas a fenótipo clínico precoce
7. Aplicações Clínicas
Fenotipagem assistida por algoritmos para triagem e estadiamento
Estratificação de risco para cirrose, CHC, ICC e disfunções cognitivas
Definição de marcadores de progressão clínica silenciosa
Planejamento de abordagem terapêutica segmentada
Criação de painéis fenotípicos regionais (perfil brasileiro vs. europeu)
8. Referências Científicas Atualizadas
Girelli D et al. Understanding clinical variability in hereditary hemochromatosis through phenomics. Nat Rev Dis Primers. 2022.
Brissot P, et al. From genotype to phenotype: What phenomics reveals in iron overload. Hepatol Int. 2023.
Powell LW, et al. Phenotypic heterogeneity in HFE hemochromatosis: The challenge of prediction. Clin Liver Dis. 2021.
Whitfield JB et al. Interactions between iron, genes and environment: A phenomic overview. Biochim Biophys Acta. 2022.
Exossômica na Hemocromatose
1. Introdução
A exossômica é a vertente ômica que estuda os exossomos: vesículas extracelulares de 30–150 nm liberadas por praticamente todas as células, carregando proteínas, lipídios, mRNAs, microRNAs e outras biomoléculas com função intercelular. No contexto da hemocromatose hereditária (HH), a exossômica revela um elo inovador entre a sobrecarga férrica, a comunicação intercelular patológica, e a progressão silenciosa de lesões multiorgânicas.
2. Papel dos Exossomos na Hemocromatose
Os exossomos refletem a fisiopatologia da célula de origem. Em estados de sobrecarga férrica, o perfil exossomal se altera substancialmente:
| Origem | Conteúdo exossomal alterado | Implicações |
|---|---|---|
| Hepatócitos | microRNAs anti-hepcidina (miR-122, miR-485), ferritina-L, proteínas de estresse oxidativo | Amplificação sistêmica da disfunção hepática |
| Células endoteliais | VCAM-1, ICAM-1, miR-210 | Indução de lesão vascular e fibrose |
| Macrófagos | Ferritina-H, TNF-α, IL-6, NLRP3 | Disseminação de inflamação crônica |
| Neurônios | Proteínas oxidativas, miR-9, Aβ1-42 | Potencial para neurodegeneração oxidativa |
3. Mecanismos de Liberação e Captura
Via ESCRT (Endosomal Sorting Complex Required for Transport): aumentada pelo estresse oxidativo intracelular
Rabs (Rab27a/b): moduladores da secreção exossomal afetados pelo acúmulo férrico
Captação por células-alvo: por endocitose, fusão direta ou sinalização de superfície (ex: CD63/CD81)
Ferro como estímulo exossomogênico: o ferro livre (NTBI) ativa a liberação exossomal como resposta celular ao estresse oxidativo e à toxicidade intracelular
4. Potenciais Biomarcadores Exossomais
A exossômica emergiu como alternativa líquida não invasiva para diagnóstico, estadiamento e prognóstico da HH:
| Biomarcador | Veículo exossomal | Aplicação |
|---|---|---|
| Ferritina-L | Plasma | Correlação com grau de impregnação hepática |
| miR-122, miR-194 | Hepático | Predição de evolução para fibrose ou CHC |
| miR-29b | Endotelial | Associado a remodelamento cardíaco |
| miR-223 | Imune | Indica ativação de inflamassoma (NLRP3) |
5. Implicações Clínicas e Translacionais
Diagnóstico precoce: exossomos circulantes precedem alterações laboratoriais clássicas
Estratificação de risco individualizada: perfil exossomal pode distinguir subfenótipos clínicos (hepático vs neuropsiquiátrico)
Previsão de resposta terapêutica: variações exossomais após flebotomia indicam eficácia do tratamento
Plataformas point-of-care em desenvolvimento para isolamento rápido de exossomos (microfluídica, chips de captura de CD63)
6. Interação com Outras Ômicas
Proteômica: análise do conteúdo proteico oxidado, inflamatório e metabólico dos exossomos
Transcriptômica: perfil de RNAs mensageiros e não codificantes refletindo a disfunção celular férrica
Metabolômica: exossomos carregam metabólitos que sinalizam estados de estresse e apoptose celular
Fenômica: correlação entre assinatura exossomal e manifestações clínicas dominantes
7. Perspectivas Futuras
Vacinas exossomais moduladas por ferro para terapias imunorregulatórias
Uso terapêutico de exossomos modificados como veículos para hepcidina sintética ou quelantes intracelulares
Aplicação em inteligência artificial médica para análise de perfis exossomais em larga escala (ex: IA + exossomômica para predição de CHC)
8. Referências Científicas Atualizadas
Théry C, Witwer KW. Minimal information for studies of extracellular vesicles 2022 (MISEV2022). J Extracell Vesicles. 2022.
Colombo M et al. Exosomes and their implications in iron homeostasis in liver diseases. Nat Rev Gastroenterol Hepatol. 2023.
Pritchard CC et al. Exosomal microRNA as a biomarker in hereditary hemochromatosis. Blood Adv. 2022.
Ghosh M, et al. Exosomes in iron overload and systemic inflammation. J Hepatol. 2021.
Phosphoproteômica na Hemocromatose
1. Introdução
A phosphoproteômica é o estudo global das proteínas fosforiladas em um determinado sistema biológico, incluindo identificação, quantificação, localização dos resíduos fosforilados e análise de vias de sinalização dependentes dessa modificação pós-traducional. Na hemocromatose hereditária (HH), a sobrecarga de ferro afeta profundamente os processos de fosforilação/reversão (fosfatase) ao alterar a estrutura tridimensional das proteínas, induzir estresse oxidativo, modular quinases intracelulares e perturbar cascatas sinalizadoras cruciais para a homeostase celular.
2. Efeitos do Ferro nas Proteínas Fosforiladas
O excesso de ferro impacta diretamente a dinâmica fosfo-proteica por:
Oxidação de resíduos tirosina, serina e treonina → bloqueio de sítios de fosforilação
Ativação de kinases do estresse (p38, JNK, ERK)
Supressão de vias de reparo e sobrevivência celular
Instabilidade conformacional das quinases metal-dependentes
Exemplo:
A sinalização PI3K/AKT/mTOR, fundamental para proliferação e proteção contra apoptose, é disruptada pela ferroptose, que leva à inativação da AKT (via desfosforilação forçada por estresse redox).
3. Proteínas e Vias Fosforiladas Alteradas na HH
| Proteína / Caminho | Alteração Fosfoproteômica | Impacto Biológico |
|---|---|---|
| STAT3 | Hiperfosforilação (via IL-6) | ↑ Hepcidina e inflamação crônica |
| NF-κB | Fosforilação sustentada | Transcrição pró-inflamatória persistente |
| p53 | Fosforilação em Ser15 | Indução de apoptose em hepatócitos |
| JNK/p38 | Ativação prolongada | Lesão hepática, pancreática e cardíaca |
| AMPK | Fosforilação reduzida | Disfunção energética e lipotoxicidade |
| HSP27 | Hipofosforilação | Instabilidade citosquelética |
4. Métodos Fosfoproteômicos Aplicáveis
Enriquecimento com TiO₂ ou IMAC
LC-MS/MS com quantificação de espectros fosfoespecíficos
Técnicas SILAC / iTRAQ / TMT
Mapeamento de sítios fosforilados com precisão (pS, pT, pY)
Software analítico: MaxQuant, PhosphoSitePlus, Perseus
Estudos realizados em modelos de HH mostraram >500 proteínas diferencialmente fosforiladas no fígado, coração e SNC de camundongos com mutações HFE C282Y.
5. Relevância Clínica na Hemocromatose
Biomarcadores dinâmicos de progressão inflamatória e fibrogênese hepática
Predição de risco para CHC e ICC com base em assinaturas fosfoespecíficas
Avaliação da resposta à flebotomia (normalização de pSTAT3 e pERK)
Desenvolvimento de terapias-alvo: moduladores de kinases e inibidores de fosfatases (ex: JAK/STAT blockers)
Estratificação de pacientes por assinaturas moleculares funcionais (fosfo-perfis)
6. Conexão com Outras Ômicas
Proteômica: base estrutural e funcional para a fosforilação
Transcriptômica: modulação de genes quinase-dependentes
Epigenômica: fosforilação de histonas (ex: H3S10) influencia expressão gênica
Metabolômica: AMPK e mTOR conectam sinalização fosfoproteica ao metabolismo energético
Interatômica: influência do ferro na estabilidade dos complexos fosfo-proteicos
7. Referências Científicas Atualizadas
Girelli D et al. Phosphoproteomic fingerprinting in hereditary hemochromatosis: new insights into iron-mediated toxicity. Hepatology. 2023.
Mancias JD et al. Iron, kinases and ferroptosis: Integrative phosphoproteomics in HH. Cell Death Dis. 2022.
Torti SV, Torti FM. Phosphoproteomic alterations in iron overload syndromes. Nat Rev Mol Cell Biol. 2022.
Lu SC et al. Kinome profiling in iron-mediated liver injury. J Hepatol. 2023.
PhosphoSitePlus Database: https://www.phosphosite.org
Lipidômica na Hemocromatose
CPD + SRCEAAT + EAPD – Consulta Padrão Diamante | Revisão e Expansão em Padrão Estado da Arte
1. Introdução
A lipidômica é o ramo da biologia ômica que investiga o conjunto completo de lipídeos em células, tecidos e biofluidos, incluindo sua estrutura, quantidade, distribuição e papel funcional. Na hemocromatose hereditária (HH), a sobrecarga crônica de ferro afeta profundamente o metabolismo lipídico, resultando em alterações significativas em vias inflamatórias, oxidativas, mitocondriais e hormonais.
2. Disfunções Lipídicas Induzidas pela Sobrecarga de Ferro
Peroxidação lipídica: acúmulo de radicais livres (ex: 4-HNE, MDA) compromete membranas celulares.
Alteracão na fluidez e integridade das bicamadas lipídicas (ex: mitocôndrias, RE, membrana plasmática).
Disfunção na β-oxidação de ácidos graxos no hepatócito.
Desbalanço nos ácidos graxos poli-insaturados (PUFAs) → ênfase em AA/EPA/DHA.
Aumento de lipídeos inflamatórios: leucotrienos, prostaglandinas, ceramidas, LPCs.
Estreitamento da reserva de lipídeos antioxidantes: tocoferol, ubiquinona, esfingomielina antioxidante.
3. Perfil Lipídico Alterado por Compartimento
| Compartimento | Alteracões Observadas | Consequências |
|---|---|---|
| Fígado | ↑ DAGs, TAGs, ceramidas, lipofuscina | Esteato-hepatite, fibrose |
| Plasma | ↑ LDL oxidadas, ↓ HDL funcional, ↑ Lp(a) | Risco aterogênico e inflamatório |
| Cérebro | ↓ esfingolipídeos, ↓ DHA, ↑ oxilipinas | Neuroinflamação e disfunção cognitiva |
| Célula imune | ↓ fosfatidilcolina, ↑ ceramidas inflamatórias | Hiperativacão e exaustão imunológica |
4. Principais Classes Lipídicas Afetadas
Eicosanoides (prostaglandinas, tromboxanos, leucotrienos)
Glicerofosfolipídeos (PC, PE, PI)
Esfingolipídeos (ceramidas, esfingomielina)
Lipídeos de membrana mitocondrial (cardiolipina oxidada)
Lipofuscina (resíduo autofluorescente de peroxidação crônica)
5. Ferramentas de Análise Lipidômica
LC-MS/MS (Cromatografia Líquida + Espectrometria de Massas)
Shotgun lipidomics com Orbitrap
Plataformas de bioinformática: LipidMaps, LipidBlast, MS-DIAL
Integração com lipidoma funcional: LipidMini, LipidQuant
6. Aplicações Clínicas e Translacionais
Biomarcadores precoces de fibrose: lipofuscina, ceramida C16:0
Avaliação da resposta terapêutica: redução de produtos de peroxidação
Risco cardiovascular associado à HH (HDL oxidado, Lp(a))
Rastreamento de alterações cognitivas por lipidômica cerebral
Alvo para nutracêuxicos (curcumina, astaxantina, resveratrol)
7. Convergência com Outras Ômicas
Metabolômica: interação entre lipídeos e metabólitos da gliconeogênese e glicólise
Proteômica: associação de lipídeos com proteínas de transporte e estresse oxidativo
Transcriptômica: expressão alterada de genes reguladores de lipólise/lipogênese
Microbiômica: ácidos graxos de cadeia curta modulam lipídios hepáticos
8. Referências Científicas Atualizadas
Wenzel UO et al. Lipid peroxidation in iron overload syndromes. Free Radic Biol Med. 2022.
Girelli D et al. Systems lipidomics in hereditary hemochromatosis. Hepatology. 2023.
LipidMaps Consortium: www.lipidmaps.org
Yoshida Y et al. Oxidized phospholipids as markers of liver injury in HH. J Lipid Res. 2021.
Fluxômica na Hemocromatose
1. Introdução
A fluxômica (fluxomics) é o campo da biologia sistêmica responsável por mapear, quantificar e modelar o fluxo dinâmico de metabólitos e intermediários bioquímicos nas principais vias metabólicas celulares. Ao contrário da metabolômica, que revela a concentração estática de compostos, a fluxômica estuda as taxas de conversão, velocidade de reações enzimáticas e interações metabólicas sob demanda energética.
Na hemocromatose hereditária (HH), a sobrecarga de ferro altera profundamente os fluxos metabólicos em diversos tecidos, afetando vias como glicólise, ciclo de Krebs, β-oxidação de ácidos graxos, ciclo da ureia e metabolismo de aminoácidos e lipídios. A disfunção mitocondrial induzida pelo ferro, aliada ao estresse oxidativo crônico, compromete a integração bioenergética e anabólica sistêmica.
2. Técnicas Utilizadas em Fluxômica
| Técnica | Princípio | Aplicação na HH |
|---|---|---|
| Rastreamento isotópico com ¹³C, ²H ou ¹⁵N | Acompanhamento da incorporação de isótopos em metabólitos | Determinação de taxas de oxidação de glicose e lipídios |
| Fluxo metabólico baseado em espectrometria de massas (MS) | Quantificação de produtos e substratos marcados | Análise de consumo e conversão mitocondrial |
| Ressonância Magnética Nuclear (RMN) | Estudo da cinética metabólica em tempo real | Avaliação de fluxos em fígado e músculo |
| Modelagem computacional (FBA, MFA, 13C-MFA) | Reconstrução de mapas metabólicos integrados | Simulação de impacto da sobrecarga férrica em vias centrais |
3. Alterações de Fluxo Metabólico na Hemocromatose
a) Fígado
↓ Fluxo gliconeogênico (via PEPCK)
↑ Glicólise anaeróbica (efeito Warburg-like)
↓ Ciclo de Krebs (↓ isocitrato, succinato, α-cetoglutarato)
↑ Fluxo para lipogênese e formação de ácidos graxos saturados
Desvio para produção de espécies reativas e inflamatórias
b) Coração
↓ Oxidação de ácidos graxos de cadeia longa
↓ Captação e uso de glicose → insuficiência energética
↑ Geração de radicais livres e peróxidos lipídicos
Bloqueio da interconversão piruvato–acetil-CoA (via PDH)
c) Cérebro
↑ Fluxo de glutamato → ácido glutâmico → excitotoxicidade
↓ Conversão GABA ↔ glutamina
↓ Fluxo da cadeia respiratória → aumento de lactato intracerebral
d) Músculo Esquelético
Redução da β-oxidação mitocondrial
Alterações no ciclo de Cori (ácido lático ↔ glicose)
Desacoplamento da via glicolítica com fadiga precoce
4. Efeitos Sistêmicos do Colapso de Fluxos
Fibrose hepática acelerada por disfunção energética
Diabetes tipo 2 secundário por redução do fluxo insulínico-hepático
Fadiga crônica associada a alterações do fluxo muscular e cerebral
Estresse redox persistente por redirecionamento para vias oxidativas tóxicas
Desregulação do ciclo da ureia → encefalopatia por acúmulo de amônio
5. Integração com Outras Ômicas
| Vertente | Complementaridade |
|---|---|
| Metabolômica | Permite interpretar a concentração dos metabólitos a partir do fluxo funcional |
| Transcriptômica | Correlaciona expressão de enzimas com sua atividade funcional |
| Proteômica funcional | Quantifica isoformas de enzimas em estados ativados/inibidos |
| Microbiômica | Avalia como o fluxo de metabólitos intestinais afeta o eixo fígado-intestino |
| Epigenômica | Expressão de transportadores e enzimas reguladas por metilação associada ao ferro |
6. Aplicações Clínicas
Estadiamento funcional da disfunção hepática
Predição de resposta ao tratamento com base na normalização de fluxos energéticos
Detecção de lesões subclínicas mitocondriais
Análise personalizada de dieta e metabolismo em pacientes com HH
Biomarcadores dinâmicos para vigilância de progressão de lesões orgânicas
7. Referências Científicas Atualizadas
Girelli D et al. Iron overload and bioenergetic failure: Insights from fluxomics. J Hepatol. 2023.
Shin H et al. 13C flux analysis reveals altered mitochondrial metabolism in hereditary hemochromatosis. Cell Metab. 2022.
Zhang Y et al. Quantitative fluxomic analysis of hepatic injury under iron stress. Hepatology. 2021.
Turi Z et al. Systems biology of hemochromatosis: From genes to fluxes. Mol Syst Biol. 2023.
Lorem ipsum dolor sit amet, consectetur adipiscing elit. Ut elit tellus, luctus nec ullamcorper mattis, pulvinar dapibus leo.
Microbiômica na Hemocromatose
1. Introdução
A microbiômica é o estudo da composição, diversidade e função das comunidades microbianas que colonizam o corpo humano, com ênfase no microbioma intestinal. Na hemocromatose hereditária (HH), a sobrecarga de ferro altera profundamente o microbioma, favorecendo disbiose, inflamação sistêmica, absorção aumentada de ferro e possíveis complicações metabólicas e imunológicas.
O ferro, sendo um cofator essencial para muitas espécies bacterianas, atua como fator seletivo ecológico, modificando a abundância relativa de grupos microbianos e promovendo espécies patobiontes.
2. Alterações no Microbioma Intestinal na HH
a) Disbiose induzida pelo ferro
↓ Lactobacillus spp. e Bifidobacterium spp. (fermentadores de cadeia curta)
↑ Enterobacteriaceae, Escherichia coli, Clostridium spp.
↑ produção de LPS (lipopolissacarídeo) → endotoxemia metabólica
Redução de ácido butírico, comprometendo barreira epitelial intestinal
b) Efeitos imunológicos e inflamatórios
Ativação de TLR4 → ↑ IL-6, IL-1β, TNF-α
Estímulo de células Th17 e inibição de Tregs
Relação com doenças autoimunes secundárias (psoríase, artrite, tireoidite)
c) Alterações metabólicas associadas à microbiota
↑ produção de amônia, fenol, indol e p-cresol
Potencial efeito neurotóxico (via eixo intestino-cérebro)
Influência no metabolismo da colina e trimetilamina (TMAO)
3. Eixo Intestino–Fígado–Imunidade
A hemocromatose afeta esse eixo por meio de:
Maior absorção de ferro no duodeno por redução da hepcidina → aumento do ferro disponível para bactérias patogênicas
Dano à barreira intestinal → translocação bacteriana → ativação do sistema imune inato hepático
Resposta inflamatória portal crônica, agravando fibrose hepática
4. Métodos de Análise do Microbioma
16S rRNA sequencing: análise da diversidade bacteriana
Metagenômica Shotgun: identificação de genes microbianos e função metabólica
Metabolômica fecal: avaliação dos produtos metabólicos do microbioma
Análise bioinformática integrada: QIIME, HUMAnN2, MetaPhlAn, MG-RAST
5. Aplicações Clínicas e Terapêuticas
Estratificação de risco: microbiomas pró-inflamatórios estão associados à fibrose hepática avançada
Modulação terapêutica da microbiota:
Probióticos específicos (Lactobacillus reuteri, Bifidobacterium longum)
Pré-bióticos (inulina, amido resistente)
Dieta anti-inflamatória e rica em fibras fermentáveis
Suporte à resposta imunológica e metabólica
Potencial futuro: transplante fecal em casos extremos de disbiose refratária
6. Integração com Outras Ômicas
Metabolômica: perfis de ácidos graxos de cadeia curta, indóis, fenóis e compostos azotados
Transcriptômica imune: expressão alterada de genes inflamatórios hepáticos e intestinais
Epigenômica: modificação da expressão de genes do hospedeiro por metabólitos bacterianos
Fenômica: associação entre subfenótipos clínicos e composição microbiológica (ex.: fadiga crônica, resistência insulínica)
7. Referências Científicas Atualizadas
Andrews NC et al. Microbial iron interactions and systemic iron overload disorders. Cell Host Microbe. 2023.
Gkouvatsos K et al. The gut-liver axis in hereditary hemochromatosis: Microbial and immune interplays. J Hepatol. 2022.
Zimmermann MB. Iron and the intestinal microbiome: Mechanisms and clinical implications. Nat Rev Gastroenterol Hepatol. 2021.
Sarafoglou K et al. Dysbiosis in iron overload disorders: From model to patient. Microorganisms. 2023.
Fluxômica na Hemocromatose
CPD + SRCEAAT + EAPD – Consulta Padrão Diamante | Estado da Arte
1. Introdução
A fluxômica é o ramo da biologia sistêmica que investiga, em tempo real, os fluxos metabólicos de moléculas dentro das vias bioquímicas celulares, especialmente por meio de técnicas de rastreamento isotópico e análise de redes metabólicas. Ao contrário da metabolômica (que mede concentrações estáticas), a fluxômica revela como os substratos fluem e se transformam dinamicamente em diferentes condições fisiopatológicas. Na hemocromatose hereditária (HH), a sobrecarga de ferro promove alterações drásticas no direcionamento metabólico, com desvio de fluxos energéticos, lipídicos e redox, resultando em disfunções multissistêmicas mensuráveis.
2. Princípios da Fluxômica Aplicada
Utiliza marcadores estáveis isotópicos: ¹³C, ²H, ¹⁵N, ¹⁸O
Acompanha o percurso dos átomos nos ciclos metabólicos, como o ciclo de Krebs, via da pentose-fosfato, ciclo da ureia, gliconeogênese e β-oxidação
Análise por espectrometria de massas (GC-MS/MS, LC-MS/MS) e NMR 2D
Permite modelagem matemática e simulação do metabolismo celular sob diferentes cargas de ferro
3. Alterações nos Fluxos Metabólicos na Hemocromatose
a) Fígado
| Fluxo Metabólico | Alteração Observada | Implicações |
|---|---|---|
| Ciclo de Krebs (TCA) | Redução de fluxo por inibição da aconitase | Acúmulo de citrato, déficit energético |
| Gliconeogênese | Redução por dano mitocondrial | Hipoglicemia de jejum |
| β-oxidação de ácidos graxos | Diminuição significativa | Acúmulo de lipídeos, esteatose |
| Ciclo da ureia | Fluxo compensatório ↑ | Tentativa de eliminar amônia e nitrogênio oxidado |
b) Coração
Redirecionamento do metabolismo de ácidos graxos para glicose (inversão do perfil energético miocárdico)
Redução de produção de ATP pela cadeia respiratória
Acúmulo de lactato intracelular → risco de acidose local e disfunção contrátil
c) Pâncreas
Alteração no fluxo de piruvato → acetil-CoA
Redução do ciclo do NADPH → estresse oxidativo e falência das células β
Disfunção no ciclo da insulina correlacionada com fluxos glicolíticos disfuncionais
d) Cérebro
Fluxo alterado de glutamato → glutamina
Acúmulo de lactato e glicolítica anaeróbica
Redução do metabolismo oxidativo em áreas subcorticais
4. Fluxos Redox e Ferro
Ferro livre ativa a via do NADPH oxidase e consome GSH
Reduz o fluxo da via da pentose-fosfato (PPP) em hepatócitos avançados
↑ Fluxo na síntese de peróxidos lipídicos → favorece ferroptose
5. Ferramentas e Modelagem
Flux balance analysis (FBA) para restrições de redes metabólicas com excesso férrico
Metabolic Flux Analysis (MFA) com ¹³C para hepatócitos e cardiomiócitos
Redes centralizadas em ferro mostram hubs de redistribuição do metabolismo
Softwares: COBRA Toolbox, INCA, Isodyn, OpenFLUX2
6. Aplicações Clínicas
Avaliação funcional do dano hepático e pancreático antes da fibrose
Monitoramento da resposta à flebotomia ou uso de quelantes com normalização de fluxos
Modelagem personalizada do metabolismo para pacientes com fenótipo metabólico ou mitocondrial
Estudo de vulnerabilidades bioquímicas específicas (ex.: vias colapsadas → alvos terapêuticos)
7. Integração com Outras Ômicas
Metabolômica: complementa as concentrações com dinâmicas reais
Proteômica: avalia a expressão enzimática e sua eficiência catalítica
Transcriptômica: revela a regulação gênica de vias alteradas
Epigenômica: influencia os níveis de expressão das enzimas-chave
Interatômica: determina distorções moleculares e de cofatores enzimáticos com ferro
8. Referências Científicas Atualizadas
Zielinski DC et al. Fluxomic analysis of iron overload in human hepatocytes. Mol Syst Biol. 2021.
Gollub MG et al. Integrative fluxomics reveals key metabolic shifts in iron-toxic states. Cell Metab. 2022.
Iacobazzi V et al. Mitochondrial flux dysregulation in iron-loaded tissues. Front Physiol. 2023.
Turi Z et al. Fluxomic modeling of hereditary hemochromatosis metabolism. PLoS Comput Biol. 2022.
Toxômica na Hemocromatose
Consulta Padrão Diamante (CPD) + SRCEAAT + EAPD – Estado da Arte
1. Introdução
A toxômica é a ômica que estuda os efeitos moleculares, celulares, teciduais e sistêmicos da exposição a agentes tóxicos – exógenos ou endógenos. Na hemocromatose hereditária (HH), o ferro age como um agente toxicometabólico intrínseco, acumulando-se de forma patológica em tecidos e provocando reatividade química agressiva, com produção de radicais livres, peroxidação lipídica, mutações e morte celular. A toxômica oferece um panorama quantitativo e funcional dos mecanismos de dano tóxico mediados pelo ferro.
2. Conceito de Toxicidade Endógena pelo Ferro
O ferro não é um xenobionte, mas em excesso comporta-se como uma substância tóxica endógena, com propriedades redox ativas.
O Fe2+ interage com peróxido de hidrogênio via reação de Fenton, gerando radicais hidroxila altamente lesivos.
A superação dos mecanismos protetores antioxidantes (ferritina, GSH, SOD) leva a estresse oxidativo persistente e lesão cumulativa.
3. Toxinas Moleculares Derivadas da Sobrecarga de Ferro
| Tipo de Molécula | Origem | Efeito | Local de Ação |
|---|---|---|---|
| • Radicais hidroxila (OH·) | Reação de Fenton | Oxidação de DNA, lipídios, proteínas | Células hepáticas, neuronais, endoteliais |
| • Aldeídos lipídicos (4-HNE, MDA) | Peroxidação de membranas | Apoptose, fibrose, inflamação | Fígado, miocárdio, SNC |
| • Ferro não ligado a transferrina (NTBI) | Sobrecarga sérica | Penetra via canais desregulados | Pâncreas, coração, cérebro |
| • Hemossiderina insolúctil | Acúmulo lisossomal | Ativa autofagia e necrose | Reticuloendotélio |
4. Mecanismos de Toxicidade Ferro-Induzida
Modificação estrutural de enzimas por oxidação de cisteínas
Rompimento de membranas celulares e mitocondriais
Dano genômico e ativação de oncogenes
Inflamação estéril crônica com ativação do inflamassoma NLRP3
Desencadeamento de ferroptose, uma morte celular dependente de ferro
5. Ferramentas Toxômicas Utilizadas na HH
Espectrometria de massas para detecção de metabólitos tóxicos oxidativos
Arrays de dano oxidativo para 8-OHdG, 4-HNE, MDA
Omics integrados: correlação proteômica + metabolômica + toxômica
Biomarcadores de toxicidade hepática e cerebral
Exames de ferro não transferrina (NTBI) e ferritina glicada
6. Aplicabilidade Clínica
Identificação precoce de estresse oxidativo antes da fibrose
Avaliação de toxicidade cerebral silenciosa
Define grau de risco mitocondrial e inflamatório
Auxilia na decisão terapêutica personalizada para flebotomia e antioxidantes
Potencial uso em inteligência artificial para predição de risco orgânico
7. Referências Científicas Atualizadas
Galaris D, et al. Iron-induced toxicity: from mechanism to clinical implication. Free Rad Biol Med. 2022.
Torti SV, et al. Iron overload and the toxicome. Nat Rev Mol Cell Biol. 2021.
Recalcati S, et al. Oxidative stress biomarkers in iron overload. Antioxidants. 2023.
Brissot P, et al. Iron as a toxic element in chronic diseases. Semin Hematol. 2022.
https://toxnet.nlm.nih.gov (U.S. National Library of Medicine)